04.07.25 – Svelata una funzione finora sconosciuta di DDX11, una DNA elicasi, cioè una proteina specializzata nell’aprire la doppia elica del DNA per permetterne la replicazione e la riparazione. La ricerca è stata condotta all’Istituto di biochimica e biologia cellulare del Consiglio nazionale delle ricerche di Napoli (Cnr-Ibbc).
La scoperta, adesso, apre nuove prospettive nella comprensione e nel possibile trattamento di malattie genetiche rare, come la Warsaw Breakage Syndrome, e di disturbi neurodegenerativi come il Parkinson e l’Alzheimer. La ricerca, guidata dal gruppo diretto da Francesca M. Pisani, dirigente di ricerca del Cnr-Ibbc, e pubblicata sulla rivista Autophagy, è frutto della collaborazione con Maurizio Renna del Dipartimento di Medicina Molecolare e Biotecnologie Mediche dell’Università di Napoli “Federico II”.
«La proteina DDX11 è mutata nei pazienti affetti dalla Warsaw Breakage Syndrome (WABS), una rara malattia genetica che compromette lo sviluppo fisico e neurologico», afferma Francesca M. Pisani. E subito dopo aggiunge: «La WABS appartiene al gruppo delle coesinopatie, malattie genetiche rare causate da alterazioni del complesso proteico della coesina o delle sue proteine regolatrici, fondamentali perché la divisione cellulare avvenga correttamente». Proprio per il suo coinvolgimento nella coesione dei cromatidi fratelli (sister chromatid cohesion) durante la divisione delle cellule, la DNA elicasi DDX11è stata al centro di precedenti studi del gruppo di ricerca del Cnr-Ibbc.
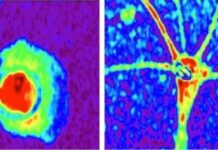
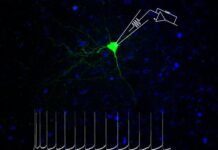
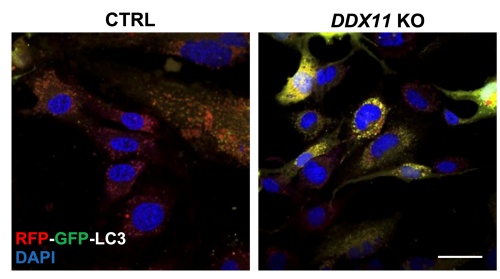
I nuovi esperimenti hanno permesso al gruppo di ricercatori del Cnr-Ibbc di scoprire che la proteina DDX11 è attiva anche nel citoplasma delle nostre cellule, dove interviene direttamente nella regolazione dell’autofagia, il processo con cui sono riciclati organelli e proteine, danneggiati e non più funzionanti.
Al riguardo, Raffaella Bonavita, prima autrice dello studio spiega: «Abbiamo osservato che, in assenza di DDX11, le cellule perdono la capacità di formare correttamente gli autofagosomi, le “navette” che trasportano rifiuti cellulari verso i lisosomi per la degradazione. Questo compromette la rimozione di aggregati tossici come quelli contenenti la proteina huntingtin mutata, associata alla Corea di Huntington».
Un altro elemento chiave emerso dallo studio riguarda l’interazione tra DDX11 e la proteina p62/SQSTM1, un recettore fondamentale per selezionare e caricare le proteine e gli organelli deteriorati negli autofagosomi. In merito, Raffaella Bonavita, sottolinea: «Anche le cellule derivate da pazienti con WABS mostrano un flusso autofagico alterato, rafforzando l’ipotesi che il malfunzionamento dell’autofagia contribuisca alla patologia».
L’autofagia è oggi considerata un meccanismo essenziale per la salute del sistema nervoso e la sua alterazione è stata collegata a numerose malattie neurodegenerative, tra cui Parkinson, Alzheimer, SLA e atassia con aprassia oculomotoria di tipo 2 (AOA2).
Il coinvolgimento diretto di DDX11 in questo processo apre prospettive del tutto inedite: «Capire come DDX11 regoli l’autofagia potrebbe rivelarsi decisivo – conclude Francesca M. Pisani – non solo per la comprensione delle basi molecolari della WABS, ma anche per lo sviluppo futuro di strategie terapeutiche contro i disturbi neurodegenerativi».
Il lavoro è stato realizzato con il supporto del progetto europeo CohesiNet, dedicato alla biologia della coesina e alle coesinopatie, e del progetto nazionale CNCCS-B (FOE – CNR), centrato sulle malattie rare.
https://www.cnr.it
https://doi.org/10.1080/15548627.2025.2507617
https://www.cohesinet.eu/
https://heos.it/category/scienze/
Vedi anche
https://heos.it/category/libri-in-vetrina-25/